Chapitre 12: Réactions acide–base
Plan
Le pH
Le caractère acide ou basique d'une solution est mesuré par le pH, une grandeur sans unité.
Une solution est:
- acide si:
- basique si:
- neutre si:
Relation de Sørensen
Le pH est lié à la concentration des ions oxonium par la relation:
Incertitudes lors des mesures de pH
Une mesure de pH avec un pH-mètre de lycée s'effectue avec une incertitude absolue de 0,05 unité de pH. La concentration en ions oxonium calculée à partir du pH ne peut contenir au mieux deux chiffres significatifs.
Produit ionique de l'eau
Toute solution aqueuse contient des ions oxonium et des ions hydroxyde en raison de l'équilibre d'autoprotolyse de l'eau.
On constate expérimentalement que le produit [H3O+].[HO-] est une constante, on l'appelle produit ionique de l'eau noté Ke.
Utiliser le produit ionique de l'eau
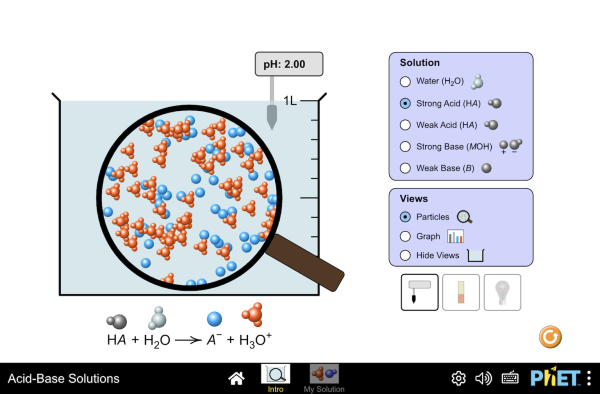
- Calculer les concentrations [H3O+] et [HO-] d'un solution de pH=2,0
- Calculer les concentrations [H3O+] et [HO-] d'un solution de pH=7,0
- Calculer les concentrations [H3O+] et [HO-] d'un solution de pH=10,0
Contrôle du pH : solution tampon
Pour contrôler le pH d'un milieu, on utilise une solution tampon.
Une solution tampon est une solution dont le pH varie peu par ajout de petites quantités d'acide, de base ou d'eau.
Le contrôle du pH joue un grand rôle en milieu biologique.
pH du sang
Le pH du sang doit être compris entre 7,38 et 7,42.
-
Si le pH devient inférieur à 7,38, on parle d'acidose.
Couples acide/base
À la différence des couples d'oxydoréduction qui échangent des électrons, les couples acide/base échangent des ions hydrogène H+ (ou protons).
Acide et base au sens de Brönsted
- Acide de Brönsted
Un acide est une espèce chimique capable de céder un ou plusieurs ions hydrogène H+.
- acide carboxylique
- eau
- Base de Brönsted
Une base est une espèce chimique capable de capter un ou plusieurs ions hydrogène H+.
- amine
- eau
Demi-équation acide-base
On associe à un couple acide-base une demi-équation d'échange de proton sous une des forme suivante:
- acide/base : acide = base + H+
- AH/A- : AH = A- + H+
- BH+/B : BH+ = B + H+
- Couple de l'acide éthanoique
- Couple de la base méthanamine
- Couples de l'eau
Acide et bases fortes : réactions totales
Les acides et bases fortes réagissent de façon totale avec l'eau (ou entre eux).
- réaction totale
Une réaction est totale si les réactifs réagissent entièrement jusqu'à la disparition du réactif limitant.
On utilise une simple flèche pour l'écriture de ce type de réactions:
- acides forts: chlorure d'hydrogène : HCl(g), acide nitrique : HNO3(l).
- bases fortes: l'hydroxyde de sodium NaOH(s), éthanolate de sodium : NaC2H5O.
Calcul du pH
- cas d'un acide fort de concentration c:
- cas d'une base forte de concentration c:
Réaction entre un acide fort et une base forte
Ce type de réaction est totale et libère une grande énergie thermique.
Exemple : réaction entre l'acide chloryhydrique et la soude.

Equation de réaction :
Calcul de l'élévation de température.(Qréaction = -55 kJmol-1)
Acides et bases faibles : notion d'équilibre chimique
Les acides et bases faibles réagissent de façon équilibrée avec l'eau (ou entre eux).
- Equilibre chimique
Un équilibre chimique est une réaction non totale. Dans l'état final, le réactif limitant n'est pas entièrement consommé et les réactifs et les produits coexistent.
On utilise une double flèche pour l'écriture de ce type de réactions:
- acide faible: l'acide éthanoïque
- base faible: l'ammoniac
Constante d'acidité KA et pKA
La force d'un acide est mesurée par sa constante d'acidité KA.

By OpenStax - https://cnx.org/contents/havxkyvS
ZIP Download:https://cnx.org/exports/85abf193-2bd2-4908-8563-90b8a7ac8df6@9.524.zip/chemistry-9.524.zip,
CC BY
4.0, Link
Pour un couple acide/base:
On utilise souvent le pKA:
Diagrammes de prédominance
Un diagramme de prédominance indique quelles espèces chimiques acides ou basiques sont majoritaires en fonction du pH.
On peut démontrer que:
Donc:
- si pH = pKA: [base] = [acide]
- si pH < pKA: [acide] > [base]
- si pH > pKA: [base] > [acide]
Diagramme de prédominance des acides carboxylique
|
Couple |
pKA |
|---|---|
|
|
|
Diagramme de prédominance des amines
|
Couple |
pKA |
|---|---|
|
|
|
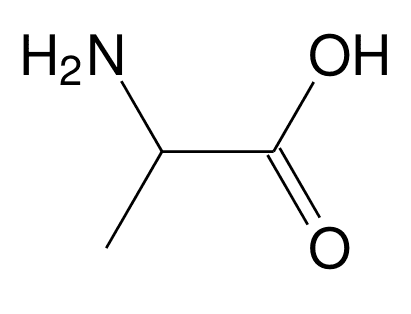
Diagramme de prédominance des acides aminés
Composés bifonctionnels contenant des groupes fonctionnels carboxyle et amine et possédant ainsi deux pKA.
l'alanine : pKa1=2,33, pKa2=9,71 à 25 °C