Vous êtes sur une version archivée de lyceum.fr de l'année 2018/2019. Revenir au présent.
Équation chimique
Pour décrire l'évolution d'un système chimique, on utilise le modèle de la réaction chimique:
- réaction du glucose dans les muscles.
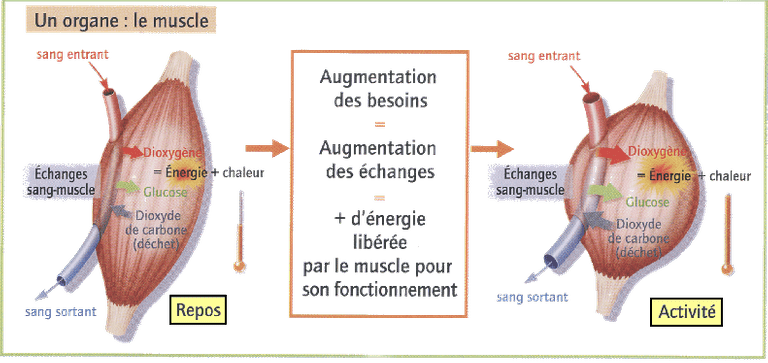 Cours de 5ème de Benoit Ramière-Licence CC
Cours de 5ème de Benoit Ramière-Licence CC
Des échanges d'énergie peuvent se produire lors d'une transformation chimique.
Equilibrage d'une équation chimique
Tous les éléments et charges électriques présents dans les réactifs doivent se retrouver dans les produits : c'est la loi de conservation des éléments et de la charge électrique.
Pour respecter cette loi, il faut équilibrer l'équation de la réaction en utilisant des nombres stœchiométriques que l'on place devant les formules brutes des molécules.
L'équation équilibrée de la réaction du glucose C6H12O6 avec le dioxgène O2 s'écrit :