Chapitre 4: Analyse spectrale en chimie
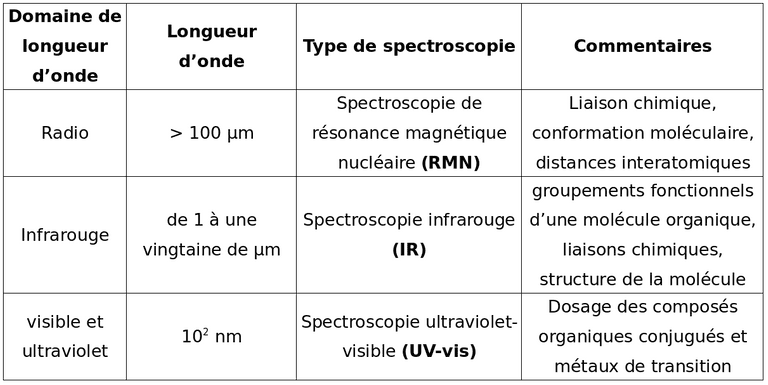
La spectroscopie consiste à déterminer la structure des molécules en observant le spectre obtenu lorsque elles interagissent avec les ondes électromagnétiques.
Wikipedia article sur la spectroscopie
Voici une vidéo du site http://www.universcience.tv intitulée La nature au labo qui montre les étapes du travail de laboratoire de l'Institut de Chimie des Substances Naturelles qui:
- Recherche des molécules thérapeutiques dans les plantes,
- puis les isole,
- les identifie grâce aux techniques de spectroscopie,
- et enfin recherche les méthode de synthèse.
La spectroscopie UV-visible
Vous avez vu en première S que les molécules colorées absorbent dans le domaine visible en raison de la présence de liaisons doubles conjuguées. Les autres molécules, incolores absorbent dans l'UV.
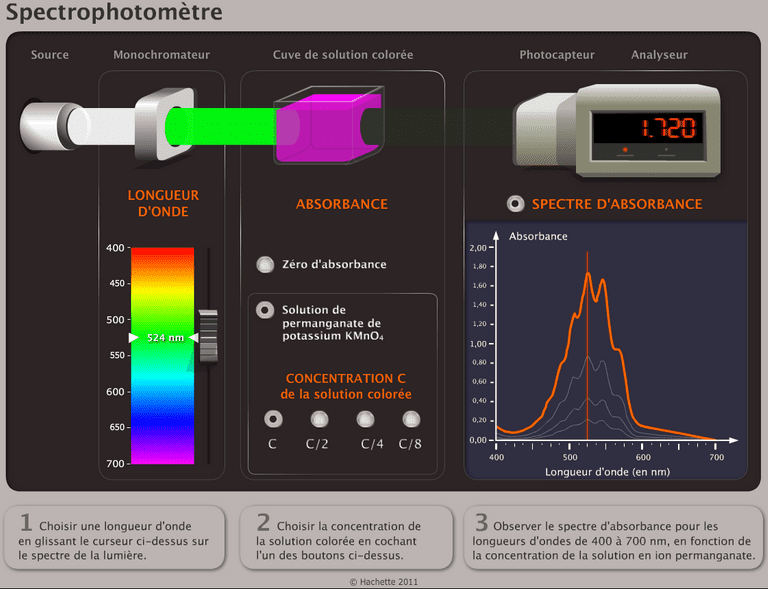
Un spectrophotomètre permet de mesurer l'absorbance d'une solution en fonction de la longueur d'onde.
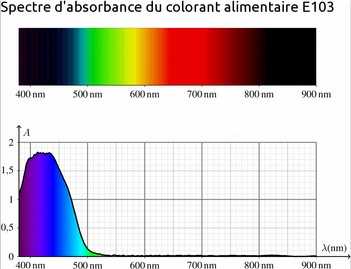
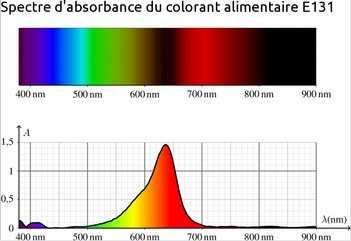
Spectres d'absorption UV-vis des colorants alimentaires :
Spectre d'absorption et couleur
Si la solution n'absorbe que dans un seul domaine de longueurs d'onde, sa couleur est complémentaire de celle des radiations absorbées.
Couleur des colorants alimentaires
Donner les couleurs des deux colorants alimentaires E103 et E131.
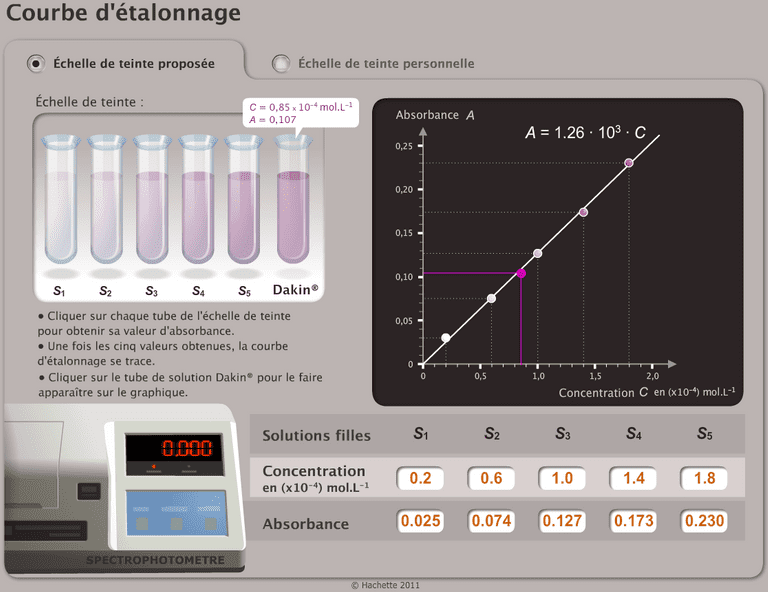
Absorbance et concentration: loi de Beer-Lambert
Pour des solutions suffisamment diluées, l'absorbance est proportionnelle à la concentration de l'espèce chimique colorée. C'est la loi de Beer-Lambert.
Notations
- : Absorbance de la solution (sans unité)
- : Coefficient d'extinction molaire ()
- : largeur de la cuve ()
- : concentration molaire de l'espèce colorée
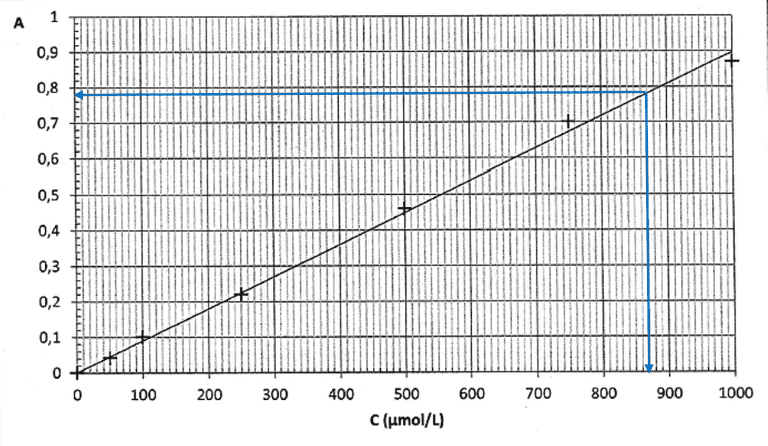
Dosage par étalonnage du diiode (Pondichery 2012)
La courbe d’étalonnage de l’absorbance en fonction de la concentration molaire C en diiode est fournie en annexe.
- La courbe d’étalonnage obtenue est-elle en accord avec la loi de Beer-Lambert? Justifier.
On mesure l'absorbance de la solution S: A = 0,78.
- Déterminer graphiquement la concentration molaire $C_{S exp} en diiode de la solution S.
La spectroscopie infrarouge (IR)
La spectroscopie IR permet de mettre en évidence les types de liaisons présentes, et ainsi les groupes fonctionnels de la molécule.
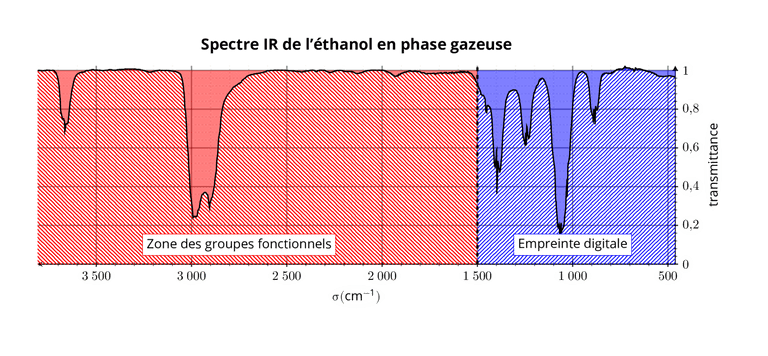
Lecture d'un spectre IR
Un spectre IR représente:
- En ordonnée la transmittance, ou parfois l'absorbance. (Une faible transmittance correspond à une grande absorbance)
- en abscisse le nombre d'onde , exprimé usuellement en . L'axe est généralement orienté vers la gauche.
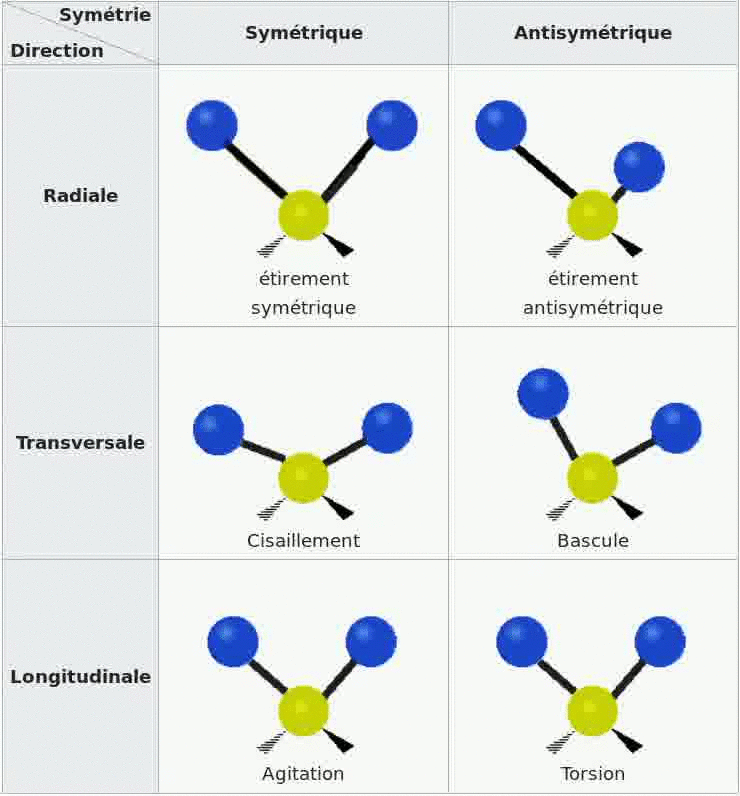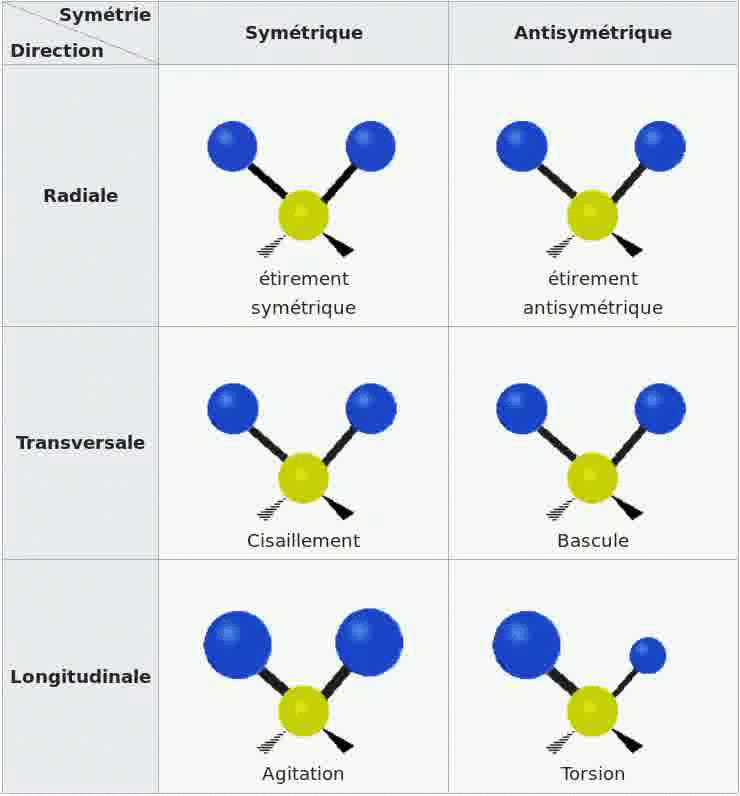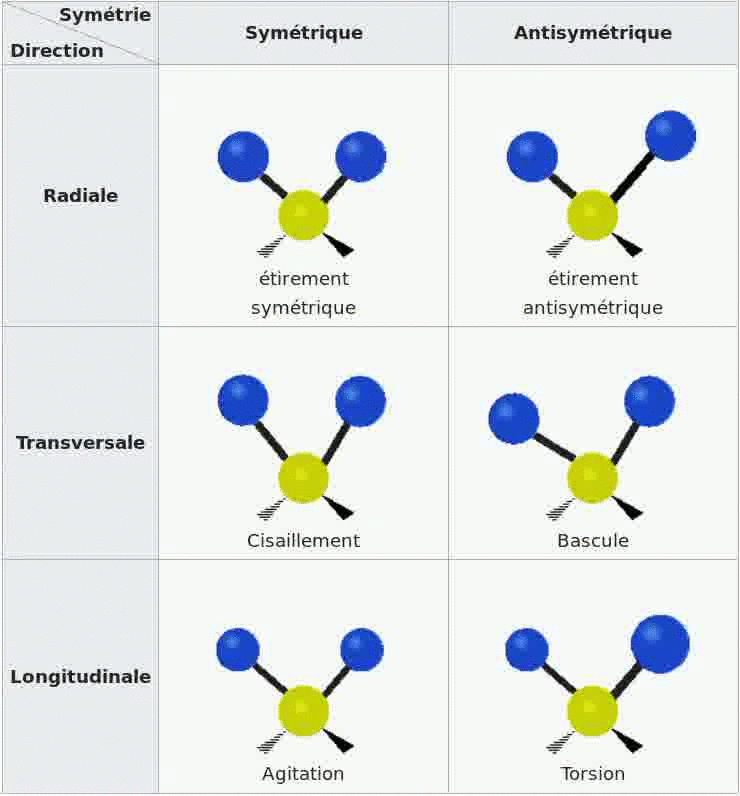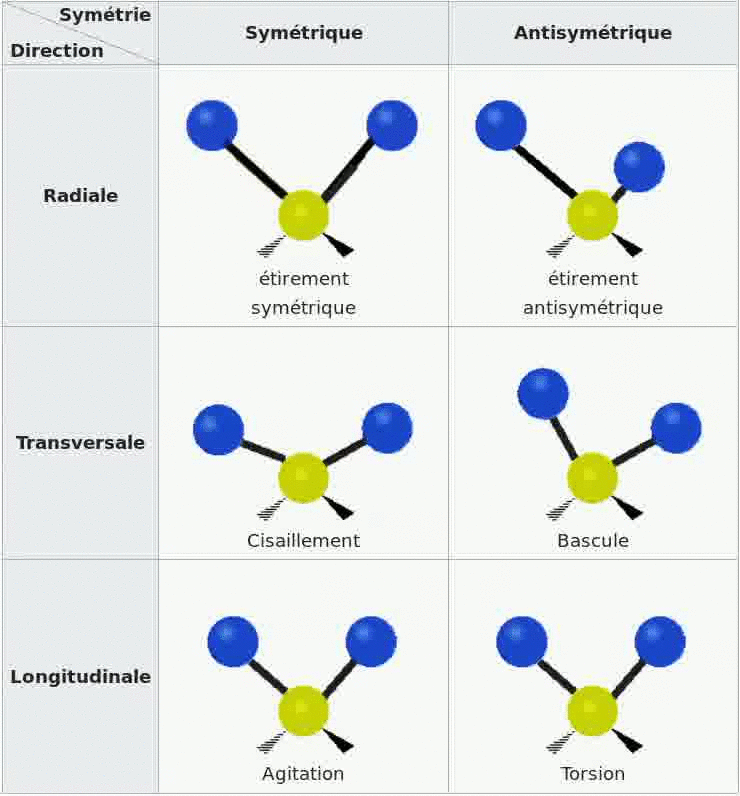
Spectroscopie IR et vibrations
Les bandes d'absorption d'un spectre sont dues au fait que les molécules de l'échantillon se mettent en
vibration sous l'effet des ondes IR, il existe divers types de vibrations possibles.
 Wikipedia article
sur la spectroscopie infra-rouge
Wikipedia article
sur la spectroscopie infra-rouge
Un spectre IR communément décomposé en deux zones :
- : Zone des groupes fonctionnels
Elle permet de déterminer les types de liaisons présentes, et ainsi les groupes fonctionnels de la molécule.
- : Empreinte digitale de la molécule
Cette zone contient un grand nombre de bandes d'absorption qui permet d'identifier une molécule à partir d'un spectre de référence.
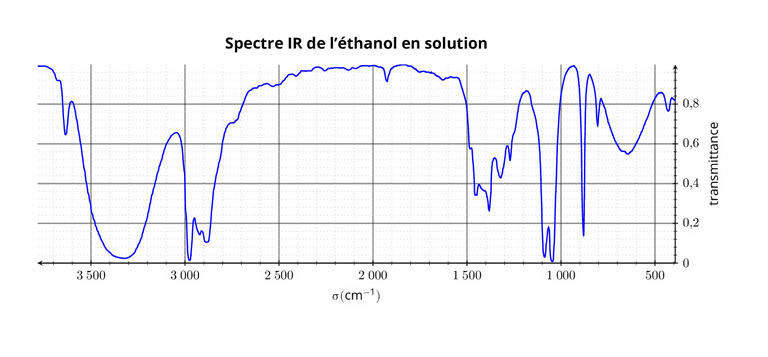
Mise en évidence de liaisons hydrogène
La position, l'intensité et la forme des bandes d'absorption dépend également de l'environnement de la molécule. Il est ainsi possible de mettre en évidence des liaisons hydrogène sur un spectre IR.
Par exemple, la bande de la liaison -OH est fortement modifiée en présence de liaison hydrogène( en phase condensée). Cette bande est:
- fine à 3600-3700 en phase gazeuse,
- large à 2500-3400 en phase condensée.
Spectroscopie RMN du proton
Voici une vidéo de la maison de la chimie montrant comment les méthodes de spectroscopie IR et RMN peuvent être utilisées pour identifier de façon complète une molécule.
- La spectroscopie IR permet d'identifier les groupes caractéristiques de la molécule.
- La spectroscopie RMN du proton permet de déterminer l'environnement des atomes d'hydrogène de la molécule, et donc indirectement la structure de sa chaîne carbonée.
Protons équivalents et signaux
Un spectre RMN présente des signaux correspondant aux atomes d'hydrogène de la molécule.
Chaque signal, est caractérisé par son déplacement chimique δ, exprimé en ppm(parties par million).
- Protons équivalents
Des protons qui ont le même environnement chimique dans une molécule sont équivalents. Ils ne forment qu'un signal sur le spectre RMN
- a 3 groupes de protons équivalents.
- : a 2 groupes de protons équivalents.
- : a 1 groupe de protons équivalents.
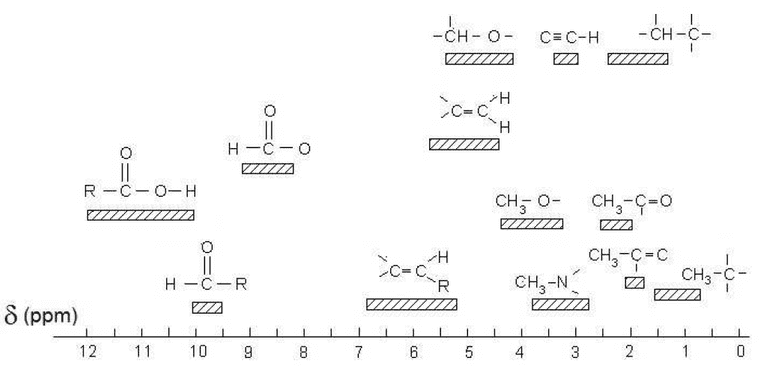
Tables de données RMN
Le déplacement chimique d'un groupe de protons dépend de son environnement. Plus un atome d'hydrogène est proche d'un atome électronégatif, et plus son déplacement chimique est élevé. Des tables de données rassemblent les déplacements chimiques mesurés.
Prédictions de spectres
L'école polytechnique fédérale de Lausanne propose un service de prédictions de spectre RMN à l'adresse suivante: http://www.nmrdb.org/new_predictor/
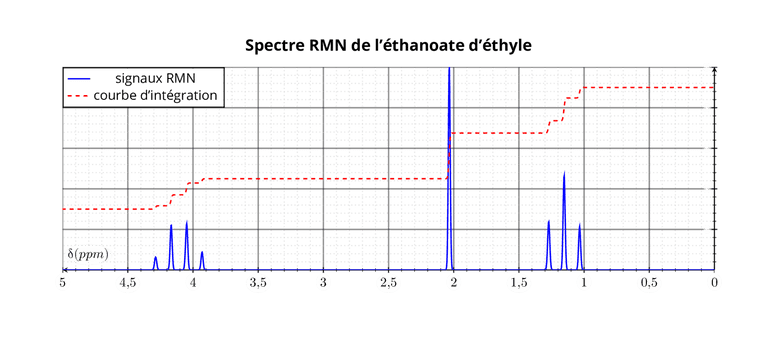
Courbe d'intégration et nombre de protons équivalents
Parfois les spectres présentent une courbe d'intégration formée de paliers. La hauteur du saut créé par un signal est proportionnelle au nombre de protons présents dans ce signal.
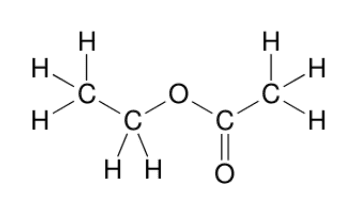
Le méthanoate d'éthyle présente deux signaux dont les hauteurs relatives sont 1-3 sur la courbe d'intégration.
Multiplicité du signal et voisins
Le signal n'est pas toujours un pic fin et unique, il peut comporter plusieurs pics et est alors appelé multiplet.
Le nombre de pics du signal dépend du nombre de protons voisins.
- Protons voisins
Des protons sont voisins s'ils sont portés par des atomes voisins.
Règle des (n+1)-uplets:
Un groupe de protons équivalents ayant n protons voisins présente un signal sous la forme d'un multiplet de (n+1) pics.