Réaliser un dosage c'est déterminer, avec la plus grande précision possible, la concentration d'une espèce chimique dissoute en solution.
Dosage par étalonnage
Un dosage par étalonnage consiste à déterminer la concentration d'une espèce en solution en comparant une grandeur caractéristique de la solution : absorbance, conductivité électrique, à la même grandeur mesurée pour des solutions étalons.
Dosage spectrophotométrique du diiode
Exercice
2 Bac S Pondichéry 2012.
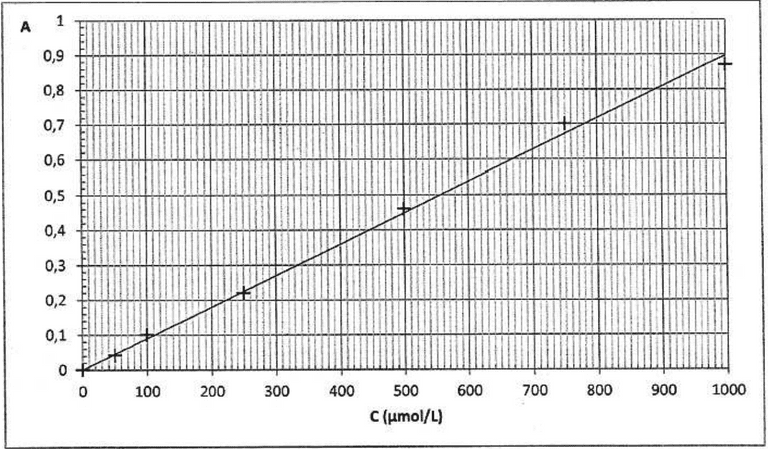
Absorbance de la solution S : A = 0,78.
Déterminer graphiquement la concentration molaire en diiode de la solution S.
Dosage par titrage
Un dosage par titrage est une technique de dosage mettant en jeu une réaction chimique. La réaction de titrage doit être totale, rapide et unique.
By Mehinger - Syrabas-titrering.svg,
CC BY-SA 4.0, Link
Équivalence d'un titrage
L'équivalence d'un titrage se produit quand la solution titrante et la solution titrée ont réagi dans les proportions stœchiométriques.
C'est à l'équivalence qu'on détermine la concentration du réactif titré.
Relation à l'équivalence
Soit la réaction de titrage d'équation:
On peut montrer qu'à l'équivalence:
Dans le cas particulier où la stœchiométrie est a=1, b=1, la quantité de réactif titrant versé à l'équivalence est égale à la quantité initiale de réactif titré:
Titrage d'un acide(titré) par une base(titrant) avec une stoechiométrie 1-1:
Ou en termes de concentrations:
On peut en déduire La concentration de l'acide:
Titrage iodométrique
Lors du titrage d'un volume V1 = 10,0 mL une solution de thiosulfate de sodium par une solution de diiode concentration c2 = 1,0×10-3 mol.L-1 on observe l'équivalence pour un volume V2E = 9,5 mL.
Exprimer puis calculer la concentration c1 en diiode de la solution titrée sachant que la réaction support du titrage a pour équation :
Comment repérer l'équivalence d'un titrage ?
Le passage de l'équivalence correspond à un changement de réactif limitant:
- avant l'équivalence : c'est le réactif_________________qui est en excès.
- après l'équivalence : c'est le réactif_________________qui est en excès.
Suivi d'une grandeur
Suivant le type de réaction, le suivi d'une grandeur(pH/conductivité σ) permet d'observer le changement de réactif limitant :
Titrage du vinaigre dilué par la soude
Suivi pH-mètrique
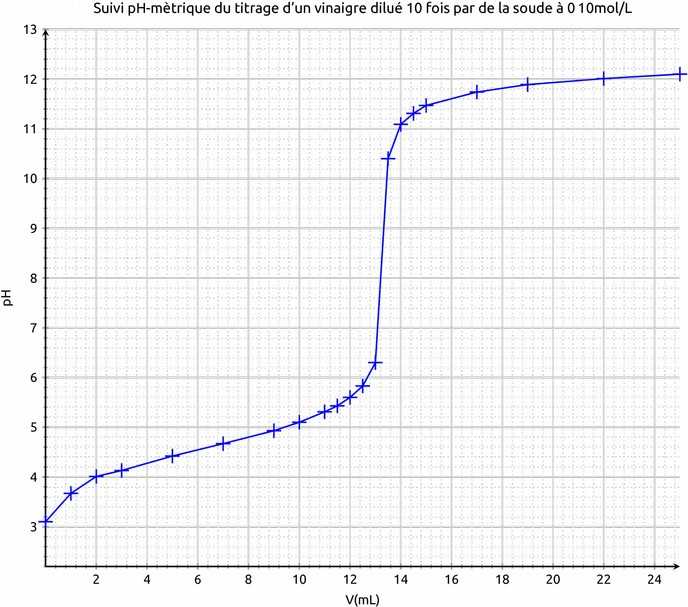 Le repérage de l'équivalence peut-être obtenu par la méthode des tangentes
http://labolycee.org/anims/methode-tangente.swf
Ou par le calcul de la dérivée du pH en fonction du volume.
Le repérage de l'équivalence peut-être obtenu par la méthode des tangentes
http://labolycee.org/anims/methode-tangente.swf
Ou par le calcul de la dérivée du pH en fonction du volume.
Suivi conductimètrique
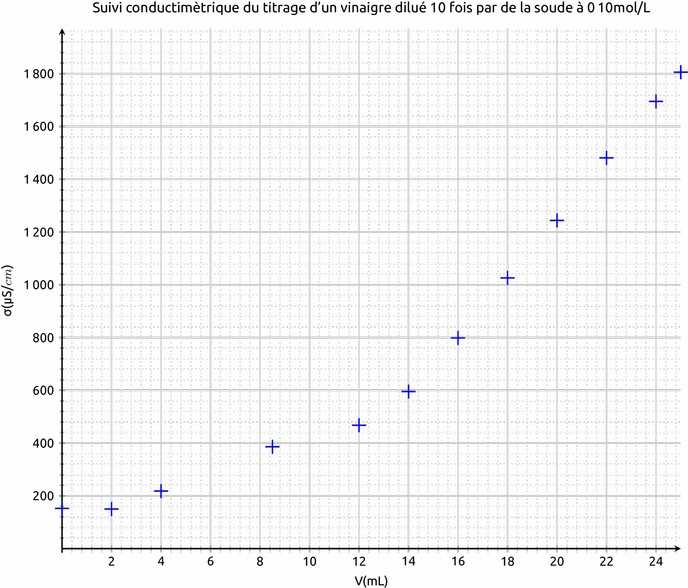 Le passage de l'équivalence entraîne une rupture de pente, avant l'équivalence le réactif titré
est consommée lors de chaque ajout de réactif titrant, alors qu'après il reste en solution.
Le passage de l'équivalence entraîne une rupture de pente, avant l'équivalence le réactif titré
est consommée lors de chaque ajout de réactif titrant, alors qu'après il reste en solution.
On donne les conductivités molaires ioniques des ions mis en jeu: λ (Na+)= 5,00 mS.m2.mol-1 ;λ (CH3COO-)= 4,09 mS.m2.mol-1 λ (HO-)= 19,8 mS.m2.mol-1
Utilisation d'un indicateur coloré de pH
Un indicateur coloré permet de repérer précisément le volume équivalent si le pH à l'équivalence appartient à la zone de virage de l'indicateur.
