Le modèle de l'atome
Un atome est constitué:
- un noyau() chargé positivement,
- un nuage d'électrons() chargés négativement.
By User:Yzmo - Own work, CC BY-SA 3.0, Link
Le noyau est constitués de nucléons:
- les protons chargés positivement,
- les neutrons qui sont électriquement neutres.
Propriétés de l'atome
Le numéro atomique Z d'un élément chimique est le nombre de protons, il définit l'élément chimique.
- Z=1: l'hydrogène
- Z=6: le carbone
- Z=29: le cuivre
Un atome est électriquement neutre, il possède autant d'électrons que de protons.
La charge élémentaire
Les protons et les électrons ont une charge électrique égale et opposée, cette valeur est appelée charge élémentaire : e = 1,6×10-19 C.*
- l'atome de cuivre contient 29 protons et 29 électrons.
Par contre, un ion est chargé, il provient d'un atome ou un groupe d'atomes qui a gagné ou perdu des électrons.
- l'ion cuivre II contient 29 protons et 27 électrons.
Les isotopes
Il existe dans la nature, différents noyaux pour un même élément chimique. On appelle ces noyaux des isotopes.
Des noyaux sont isotopes s'ils possèdent le même nombre de protons, mais un nombre différent de neutrons.
- Isotopes de l'uranium
- isotopes de l'hydrogène
Notation du noyau de l'atome
- : Symbole de l'élément chimique
- : Numéro atomique
- : Nombre de nucléons(protons et neutrons)
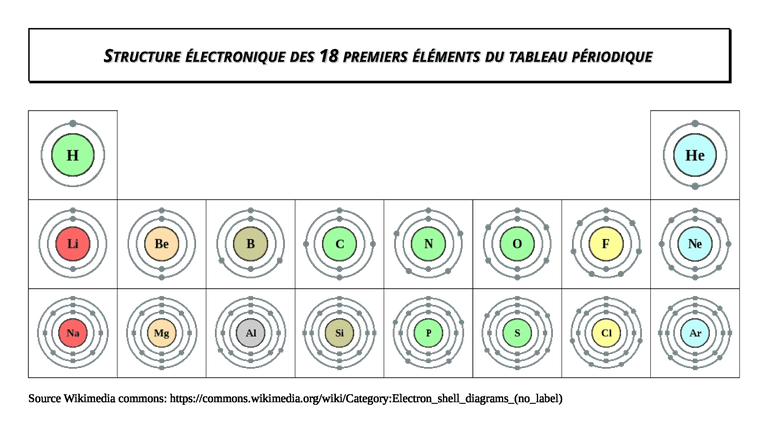
Structure électronique d'un atome
Les électrons de l'atome se répartissent sur des couches électroniques de plus en plus éloignées du noyau.
- La couche K est la plus proche du noyau, elle ne peut accueillir que 2 électrons.
- La couche L ensuite ne peut accueillir que 8 électrons.
- La couche M ensuite ne peut accueillir que 18 électrons.
Les électrons se placent préférentiellement sur les couches les plus proches du noyau.
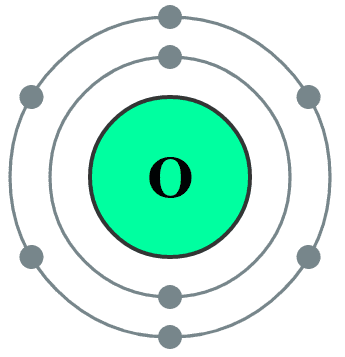
- Atome d'oxygène(Z=8): K2L6
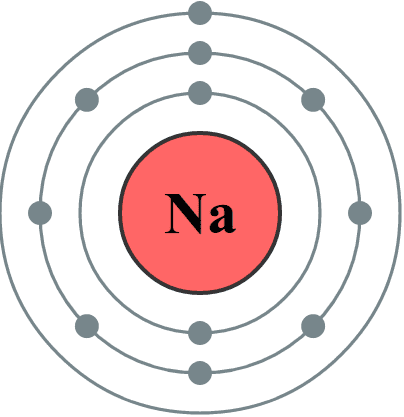
- Atome de sodium(Z=11): K2L8M1
Stabilité des atomes et ions
Règles de stabilité
Les atomes « cherchent » à acquérir une structure électronique stable semblable à celle du gaz noble(He, Ne, Ar...) le plus proche dans la classification.
- He :
- Ne :
- Ar :
Règle du duet : les éléments proches de l'hélium(Z=2) cherchent à acquérir une structure électronique K2
Règle de l'octet : les éléments proches du néon ou de l'argon cherchent à acquérir une structure électronique à 8 électrons sur la couche externe : K2L8 ou K2L8M8.
Cas des ions monoatomiques
Les atomes instables peuvent se stabiliser en gagnant ou en perdant un ou plusieurs électrons pour former des ions monoatomiques.
- L'ion lithium :
- L'ion berylium :
- L'ion sodium :
- L'ion oxyde :
- L'ion chlorure :
